Gemeinsam auf dem Weg zur Familienplanung: Diagnostik in Frauenarztpraxis und Kinderwunschzentrum
Die Beratung zur Familienplanung gehört zu den Kernkompetenzen der Gynäkologie – doch was ist sinnvollerweise dabei abzuklären und ab wann sollte ein Kinderwunschzentrum involviert werden? Dieser Artikel kann hierzu Orientierungshilfe sein.
Der Kinderwunsch stellt in der Lebensplanung vieler Paare eine sehr elementare Entscheidung dar, nur leider fällt diese häufig später als für die Fertilität zuträglich. Bei der Geburt des ersten Kindes sind Frauen in der Schweiz laut Bundesamt für Statistik bereits 31 Jahre alt (Jahr 2020) und das Durchschnittsalter der Patientinnen in einem Kinderwunschzentrum stieg auf über 35 Jahre. Das zunehmende Alter der Patientinnen, die sich wegen unerfülltem Kinderwunsch in der gynäklogischen Praxis und nachfolgend auch im Kinderwunschzentrum beraten lassen, stellt tatsächlich ein Hauptproblem dar.
Die Jahreskontrolle ist deshalb eine jährlich wiederkehrende, gute Gelegenheit, über die naturbedingte Abnahme der weiblichen Fruchtbarkeit insbesondere nach dem 35. Lebensjahr zu informieren.
In der vertrauensvollen Atmosphäre einer Frauenarztpraxis können viele Kinderwunschpaare kompetent beraten und abgeklärt werden.
Bereits beim ersten Gespräch ist es sinnvoll, folgende Punkte (Tabelle 1) mit der Patientin/dem Paar zu besprechen.
Die weiteren diagnostischen Schritte in der Frauenarztpraxis sind eine ausführliche Zyklusdiagnostik mittels Ultraschall und Blutanalysen sowie die Abklärung der anatomischen Faktoren (Uterus, Eileiter, evtl. Peritoneum) als auch ein Spermiogramm.
Das Wichtigste ist eine systematische Diagnostik vor dem Beginn jeder Therapie (z. B. monofollikuläre Stimulationen oder intrauterine Inseminationen), da die Sterilität häufig multifaktoriell bedingt ist.
Eine genaue Anamnese beider Partner ist unersetzbarer Ausgangspunkt. Sie führt auf die Spur komplikationsträchtiger Vorerkrankungen und Voroperationen und leitet zu ersten Verdachtsdiagnosen. Die Ursachen der Infertilität sind bekanntlich zu einem Drittel abhängig von männlichen und einem Drittel von weiblichen Faktoren. Ein weiterer gleich grosser Anteil ist multifaktoriell und als ungeklärte Infertilität klassifiziert.
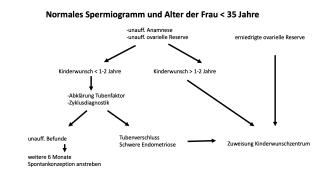
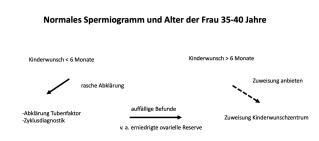
Im Rahmen der Anamneseerhebung erfolgt zugleich die Triage der Fälle, die direkt vom Kinderwunschzentrum gesehen werden sollten [2].
Zyklusdiagnostik
Eine ausführliche Anamnese hat vor allem bei der Zyklusdiagnostik eine besondere Wichtigkeit. Länge, Regelmässigkeit, Blutungsdauer, Dysmenorrhö, prämenstruelles Spotting sollten zu Beginn erhoben werden und können bereits wichtige Hinweise auf eine hormonelle Zyklusproblematik geben. So kann davon ausgegangen werden, dass bei einer Frau mit einem regelmässigen Zyklus von 26 bis 35 Tagen, ohne prämenstruelles Spotting, keine endokrine Problematik vorliegt. Jedoch kann es bei unerfülltem Kinderwunsch über ein Jahr dennoch Sinn machen, eine Zyklusdiagnostik mit Hormonstatus durchzuführen.
Frühzyklischer Ultraschall (2.–5. Zyklustag)
Im frühzyklischen Ultraschall werden die Ovarien, die Anzahl der sichtbaren Follikel, das Endometrium, sowie das Myometrium beurteilt.
Die antralen Follikel sind definiert durch ihre Grösse von unter 10 mm, gemessen im transvaginalen Ultraschall in der frühen Follikelphase (Abb. 1a–c). Die Anzahl der sichtbaren Follikel (= antraler Follikel count, AFC) reflektiert die ovarielle Reserve [3]. Ein normaler AFC liegt zwischen fünf und 15 Follikeln pro Ovar. Liegt der AFC unter fünf, so ist die ovarielle Reserve eingeschränkt, bei Werten über 20 Follikeln pro Seite besteht ein Verdacht auf PCO-Syndrom (ESHRE Guidelines).
In der frühen Follikelphase ist das Endometrium schmal. Ebenfalls werden Auffälligkeiten im Myometrium wie Myome, Zeichen einer Adenomyose oder Hinweise auf eine Saktosalpinx dokumentiert.
Frühzyklische Hormondiagnostik
Gleichzeitig zum Ultraschall in der frühen Follikelphase wird eine Blutentnahme zur Hormonanalytik durchgeführt.
Das luteinisierende Hormon (LH) und das follikelstimulierende Hormon (FSH) werden im Hypophysenvorderlappen produziert und stimulieren u. a. die Follikelrekrutierung am Ovar.
Frühzyklisch liegt das LH physiologischerweise unter 10 IU/L. Erhöhte LH-Werte werden bei Patientinnen mit PCOS oder in der Menopause gesehen. Ein LH/FSH-Quotient von >2 ist typisch bei hyperandrogenämischen Ovarialfunktionsstörungen, wie z. B. dem PCOS. Der typische LH-Peak, welcher die Ovulation auslöst, liegt üblicherweise bei >20 IU/L.
Ebenfalls sollte das FSH frühzyklisch unter 10 IU/L liegen. Werte >25 IU/L sind Ausdruck der beginnenden Menopause [4] und lassen in der Regel darauf schließen, dass die Follikel durch Gonadotropinstimulation kaum noch beeinflusst werden können [5].
Estradiol (E2) und Progesteron sind in der frühen Follikelphase tief, das heisst für das E2 unter 200 pmol/l und das Progesteron unter 1 ng/ml.
Das Antimüller Hormon (AMH) wird in den Granulosazellen der Sekundärfollikel am Ovar produziert und ist ein verlässlicher Marker der quantitativen ovariellen Reserve, jedoch nicht deren Qualität. Ebenfalls sagt es nichts über die Wahrscheinlichkeit einer Spontankonzeption aus. Unter kombinierten Antikonzeptiva kann der Wert bis zu 30 % niedriger sein. Im Rahmen einer künstlichen Befruchtung ist das AMH ein guter Vorhersagewert für die Anzahl der zu erwartenden Oozyten. Somit ist die Bestimmung des AMH vor allem in der Vorbereitung und Planung einer künstlichen Befruchtung wichtig und kann initial bei einer Patientin unter 35 Jahren mit regelmässigem Zyklus zurückgestellt werden. Viele Patientinnen wünschen jedoch die Bestimmung des AMH aufgrund seiner enormen medialen Präsenz. Hier ist eine gute Aufklärung wichtig, da ein niedriges Resultat sonst zu grosser Verunsicherung führen kann [6].
Die Schilddrüsendiagnostik mittels Bestimmung des TSH kann zyklusunabhängig erfolgen. Bei erhöhtem oder erniedrigtem TSH sollte fT3 und fT4 nachgefordert und die Schilddrüsenantikörper bestimmt werden. Im Falle von positiven Schilddrüsen-Antikörpern wird die Überweisung an den Endokrinologen empfohlen und der Therapiebeginn mit Levothyroxin.
Die Androgene werden bei auffälliger Anamnese (Acne, Hirsutismus, Virilisierung) bestimmt. Initial können das Gesamttestosteron und das SHBG abgenommen werden. Sport erhöht das SHBG. Somit können Patientinnen mit tiefen SHBG-Werten und Hirsutismus zu mehr sportlicher Aktivität motiviert werden, um die relative Hyperandrogenämie zu senken. Bei ausgeprägtem Hirsutismus sollte das 17alpha-Hydroxyprogesteron (17alpha-OHP) bestimmt werden, welches als Markerhormon des Late-Onsete-AGS gilt. Ist der Wert über >6 nmol/l erhöht, sollte eine genetische Abklärung erfolgen [7].
Erhöhte Prolaktinwerte können ursächlich einer Zyklusstörung sein. Weitere typische Symptome einer Hyperprolaktinämie sind eine Galaktorrhö und eine Mastodynie. Das ebenfalls im Hypophysenvorderlappen produzierte Hormon kann stressbedingt erhöht sein, beispielsweise auch nach manueller Untersuchung oder Ultraschall der Brust. Erhöhte Werte sollten deshalb kontrolliert werden mit einer Blutentnahme in Ruhe und nach 30 Minuten Liegen. Zeigt sich ein Wert über 50 ug/l bzw. 1000 mU/l sollte ein MRI der Hypophyse zum Ausschluss eines Hypophysenadenoms erfolgen. Therapeutisch wird mit Cabergolin 0,5 mg eine halbe Tablette pro Woche begonnen. Da auch eine Schilddrüsenfunktionsstörung zu einer Hyperprolaktinämie führen kann, sollten immer zuerst die Schilddrüsenwerte überprüft und allenfalls therapiert werden [8].
Infektionsscreening
Eine positive Chlamydienserologie (IgA und IgG) kann auf einen tubaren Faktor hinweisen. Eine akute Infektion muss bei positiven Antikörpern immer mittels Cervix-Abstrich ausgeschlossen werden.
In Hinblick auf eine allfällige Schwangerschaft kann die Bestimmung der Rubella- und Varizellenserologien diskutiert werden, da bei fehlender Immunität eine aktive Impfung mittels eines Lebendimpfstoffes erfolgen sollte.
Präovulatorischer Ultraschall-Index
Der präovulatorische Ultraschall wird – je nach Zykluslänge – ein bis zwei Tage vor dem erwarteten Eisprung durchgeführt. Typischerweise zeigt sich ein trilaminares Endometrium von über 7 mm und ein dominanter Follikel von über 18 mm (Abb. 2a und b).
Zudem ist der periovulatorische Zervixschleim durchsichtig und gut beim Auseinanderziehen der Finger spinnbar. Hierfür kann die Patientin zur Selbstuntersuchung angeleitet werden.
Bei typischem Ultraschallbild ist eine Hormonbestimmung nicht notwendig. Falls doch eine erfolgt, so ist der Estradiolwert bei einem reifen Follikel typischerweise über 800 pmol/l, der LH- und Progesteronwert präovulatorisch noch niedrig. Die Ovulation erfolgt typischerweise 28–36 Stunden nach dem Anstieg des LHs und 8–20 Stunden nach dem LH-Peak [9, 10].
Lutealphase
Eine Lutealphaseninsuffizienz kann bereits mit einer genauen Anamnese diagnostiziert werden. So kann davon ausgegangen werden, dass bei einer Lutealphase von über zwölf Tagen, ohne prämenstruelles Spotting, keine Lutealphaseninsuffizienz vorliegt. Um eine Ovulation zweifelsfrei nachzuweisen, kann 7–9 Tage nach dem erwarteten Eisprung Progesteron bestimmt werden. Werte >10 ng/ml sprechen für eine vollwertige Lutealphase und beweisen die stattgehabte Ovualation. Hier ist noch anzumerken, dass ein Cut-Off-Wert des Progesterons in der Lutealphase umstritten ist und vor allem die Klinik entscheidend ist [11].
Die Basaltemperatur steigt typischerweise in der zweiten Zyklushälfte um 0.3 Grad Celsius über mindestens zehn Tage an. Die tägliche Bestimmung der Basaltemperatur hat jedoch mit der heutigen Hormonanalytik und dem transvaginalen Ultraschall stark an Bedeutung eingebüsst.
Uteriner, tubarer und peritonealer Faktor
Schätzungen gehen davon aus, dass etwa jede zehnte Patientin im fortpflanzungsfähigen Alter an einer Endometriose leidet. Im Kollektiv der Kinderwunschpatientinnen liegt diese Zahl mit 35–40 % deutlich höher [12]. Man geht davon aus, dass nicht nur die ovarielle Endometriose, sondern auch die peritoneale Endometriose die Eizellqualität vermindert. Auch führt die Endometriose mit Fortschreiten der Krankheit zur Zerstörung von gesundem Gewebe, zu Verwachsungen und Vernarbungen und somit zu Funktionseinbussen. Typischerweise leiten uns Symptome auf die Verdachtsdiagnose Endometriose, aber nicht selten korreliert die Symptomausprägung nicht mit der Schwere der Erkrankung.
Legen Anamnese oder Laborbefunde den Verdacht einer vorausgegangenen Infektion im Bauchraum nahe, können Verwachsungen die Funktion von Tuben und Ovarien beeinträchtigen. Sonographisch lassen sich häufig weder Endometriose noch Verwachsungen eindeutig darstellen [13].
Sind alle Befunde der Basisabklärung unauffällig (Zyklusdiagnostik und Spermiogramm) und weisen uns Anamnese oder Laboruntersuchungen auf das Vorliegen eines möglichen tubaren/peritonealen Faktors hin, ist die Indikation einer diagnostischen Laparoskopie gegeben.
Dabei kann mit einer Chromopertubation/Blauprobe die Durchgängigkeit der Tuben einfach geprüft werden. Liegt ein peripherer Tubenverschluss vor, kann dieser mikrochirurgisch saniert werden. Die physiologische Anatomie wird wieder hergestellt, indem Verwachsungen gelöst und Endometrioseherde entfernt werden, was gleichzeitig eine histologische Sicherung der Verdachtsdiagnose erlaubt und die Restitution der Funktion der Organe ermöglicht. Die Laparoskopie ist somit therapeutisch. Die Rate an spontanen Schwangerschaftseintritten innerhalb von 12–18 Monaten nach Operation ist mit über 50 % erfreulich hoch [14].
Glücklicherweise kann in den meisten Fällen auf eine Operation verzichtet werden und die Eileiter können, meist im Kinderwunschzentrum, mittels Hystero-Kontrastmittel- Sonographie (HyCoSy) abgeklärt werden (Abb. 3). Das Verfahren ist wenig invasiv und kann ambulant durchgeführt werden. Unter sterilen Bedingungen wird ein Katheter in den Cervicalkanal gelegt und blockiert, um Rückfluss zu vermeiden. Über den Katheter wird anschliessend das deutlich echogene Kontrastmittel ins Cavum eingebracht. Das Kontrastmittel gelangt danach in die Tubenwinkel und kann so über den gesamten Tubenverlauf bis zum Austritt in den Bauchraum verfolgt werden.
Bereits in den 1990er Jahren wurde eine Übereinstimmung von HyCoSy und der Laparoskopie zur Beurteilbarkeit der Tuben von über 90 % beschrieben [15]. Auch ist die Aussagekraft von HyCoSy und Hysterosalpingographie vergleichbar, es kann jedoch auf eine Bestrahlung und Narkose verzichtet werden [16]. Es wird in der Regel gut toleriert und die unerwünschten Nebenwirkungen sind gering [17]. Bei unklaren Befunden nach HyCoSy besteht klar die Indikation zur Laparoskopie. Gleichzeitig kann NaCl 0.9 % über den Katheter gespritzt werden, um so das Cavum zu beurteilen.
Uteriner Faktor
Grobe Fehlbildungen des Uterus werden meist bereits in der Basisabklärung diagnostiziert. Liegt aber ein Uterus arcuatus oder ein Uterus subseptus vor, entgeht das nicht selten der Aufmerksamkeit der Untersucher [18].
Die Funktion der Gebärmutterschleimhaut ist beim Fortbestand einer Schwangerschaft ab dem ca. siebten postovulatorischen Tag zentral. Ein Polyp, Verwachsungen oder chronische Entzündungen können die Funktion derart beeinträchtigen, dass eine Sterilität/Infertilität resultiert [19].
Weist uns die Anamnese auf geburtshilfliche Eingriffe wie Kaiserschnitt oder Nachcurettage hin oder sind alle Befunde der Basisabklärung unauffällig und trotzdem stellt sich keine Schwangerschaft ein, lohnt sich, die Frage nach dem uterinen Faktor weiter abzuklären. In jüngster Zeit hat sich der 3D-Ultraschall als sehr leistungsfähig erwiesen bei der Diagnose von Polypen, genauer Lokalisation von Myomen und Müllerschen Fehlbildungen (Devine, Ket al., Fertil Steril 2022; 118:19).
So ist die Hysteroskopie heute eher therapeutisch geworden. Mit einem einfachen Eingriff kann eine Verdachtsdiagnose verifiziert und auch behandelt werden .Eine Resektoskopie entfernt maximal kontrolliert das betroffene Gewebe und erlaubt eine histologische Untersuchung. Die Durchtrennung eines Septums stellt die physiologischen anatomischen Verhältnisse wieder her. Selbst bei einem unauffälligen Befund erlaubt eine Biopsie mittels Strichcurettage (wahrscheinlich am ergiebigsten in der frühen Follikelphase [Ryan E et al., Fertil Steril 2022; nn: nn) die Untersuchung der Schleimhaut auf Hinweise einer chronischen Entzündung oder das übermässige Vorliegen von Plasmazellen oder natürlichen Killerzellen. Diese Befunde ermöglichen eine kausale Therapie(Antibiotika bei chronischer Endometritis), wodurch die Schwangerschaftschancen gesteigert werden können.
Es macht Sinn, die Klärung von tubarem, peritonealem und uterinem Faktor zu verbinden. Wünscht die Patientin aber keine Operation oder liegen Kontraindikationen für eine solche vor, lassen sich die meisten uterinen Fragestellungen mittels 3D-Sonographie und mit einer Biopsie mittels einer Pipelle de Cornier klären.
Andrologischer Faktor
Bei der Abklärung des Partners kommt der Anamneseerhebung erneut eine wichtige Rolle zu.
Neben Grunderkrankungen des Patienten wirken sich auch deren Therapien auf die Spermienproduktion aus. Bekanntermassen kann es nach Chemotherapien und Bestrahlungen zu Azoospermie kommen, aber auch eine Testosterontherapie (nicht zuletzt zu Dopingzwecken) kann die Spermatogenese drosseln.
Genauso haben Lifestyle-Faktoren Einfluss auf die Fertilität und sollten ebenfalls thematisiert werden. Nikotin- und Alkoholkonsum wirken sich negativ auf die Spermiogramm-Parameter aus. Eine Kombination mehrerer Faktoren könnte den Effekt verstärken und ist stark vom Alter des Mannes abhängig [2, 20, 21, 22].
In der Basisabklärung des Mannes kommt dem Spermiogramm besondere Bedeutung zu. Neben der Gesamtanzahl und -beweglichkeit wird üblicherweise die Morphologie, also die Beurteilung der Spermienformen, überprüft [23].
Die beschriebenen Parameter bei der Spermiogrammbeurteilung sind für die Erstabklärung in der Frauenarztpraxis ausreichend.
Untere Referenzgrenzen bei der Spermiogramm-Beurteilung [23]:
|
Bei Vorliegen pathologischer Befunde wird eine zweite Bestimmung nach Ablauf von 10 bis 12 Wochen angestrebt, da die Ergebnisse Schwankungen unterliegen.
Im Falle eingeschränkter Parameter (s. Tabelle) ist zudem eine urologische Vorstellung mit körperlicher Untersuchung, Hodensonographie und Kontrolle der Hormonwerte von grosser Wichtigkeit zum Ausschluss maligner Erkrankungen oder Einleitung einer spezifischen Behandlung.
Es lässt sich festhalten, dass eine ausführliche Anamnese aufseiten des männlichen Partners und ein Spermiogramm in der Abklärung des Kinderwunschpaares zunächst ausreichend sind.
| Betreuung in Frauenarztpraxis | Direkte Zuweisung zum Kinderwunschzentrum |
|---|---|
| leichte Endometriose | Alter der Frau >40 Jahre |
| leichter andrologischer Fak-tor (ggf. zur Insemination) | schwere Endometriose |
| leichte Follikelreifungsstö-rung (zur monofollikulären Stimulation) | Status nach Chlamy-dieninfektion oder V. a. Tubenverschluss |
| - | Status nach Chlamydieninfektion oder V. a. Tubenverschluss schwere Oligozoospermie (unter 5 Mio. Spermien im Ejakulat) |
| - | Kryptozoospermie (einzelne Spermien vorhanden nach Zentrifugation) |
| - | Azoospermie (keine Spermien im Ejakulat) |
| - | Status nach drei erfolglosen Inseminationen |
Aufgabenteilung Praxis/Kinderwunschzentrum
Die Aufgabenteilung zwischen Frauenarztpraxis und Kinderwunschzentrum könnte wie folgt aussehen:
Kernaussagen
- Bei 15 % aller Paare besteht ein unerfüllter Kinderwunsch.
- Der grösste limitierende Faktor -auch unter Therapie- ist das Alter der Frau. Um keine Zeit zu verlieren, ist ein gezieltes Vorgehen in der Abklärung der Ursachen besonders wichtig.
- Da der Schritt für ein Paar ins Kinderwunschzentrum zu kommen nicht selten eine grössere Entscheidung darstellt, ist es begrüssenswert, die ersten Abklärungen in der vertrauten Umgebung der Frauenarztpraxis durchlaufen zu können. Dies stärkt auch die Arzt-Patientinnenen-Beziehung.
- Andererseits wird es immer Paare geben, die es eiliger haben, an ein Kinderwunschzentrum zugewiesen zu werden. Dort ist die Infrastruktur gegeben ,kurzfristig Termine für z. B. ein Zyklusmonitoring zu vergeben.
- Überdies bieten die Zentren teils psychologische und komplementärmedizinische Begleitung an.
- Der psychische Druck bei Kinderwunsch wächst erheblich mit der Zeit, und so ist ein rechtzeitiger Anschluss der Patienten an ein Kinderwunschzentrum sinnvoll.
Literatur
- Optimizing natural fertility: a committee opinion. Fertil Steril. 2017; 107:52–8
- Garolla A et al., Front Endocrinol 2021; 11:59
- Haadsma et al., Hum Reprod 2007;22: 1925–31
- Burger H., Endocrinol. J Sex Med. 2008; 10:2266–73
- Souter I et al., Am J Obstet. Gynecol. 2014; 211:62
- Quinn et al., Fertil Steril, 2022 Feb; doi: 10.1016/j.xfnr. 2021.11.001
- Keck C, Segerer S., Gynäkologe 2015; 48:891
- Nawroth F., Hyperprolaktinämie. Gynäkologe 2015; 48:383
- Direito A et al., Fertil Steril. 2013; 99:279–85.e3
- Holesh JE, StatPearls [Internet]. PMID: 28723025
- Sonntag B et al., Clin Endocrinol 2012;77:500
- Evans MB, Decherney AH, Fertility and Endometriosis. Clin Obstet Gynecol 2017; 60:497–502
- Goncalves MO et al., Hum Reprod 2021; 36:1492
- Dietrich M et al., J Clin Ultrasound. 1996; 24:523
- Lim CP et al., Hum Reprod. 2011; 26:967
- Vercellini P et al., Hum Reprod 2009; 24:254
- Savelli L et al., Fertil Steril 2009; 92:1481
- Soares SR et al., Fertil Steril 2000; 73:406
- Vitale SG et al., Eur J Obstet Gynecol Reprod Biol 2021; 260:70
- oedt T et al., Preconception lifestyle advice for people with infertility. Cochrane Database Syst Rev. 2021 Apr 29; 4(4):CD008189. doi: 10.1002/14651858.CD008189.pub3. PMID: 33914901; PMCID: PMC8092458
- Verón GL et al., Fertil Steril. 2018; 110:68
- Sansone A et al.Reprod Biol Endocrinol. 2018; 16:3
- WHO laboratory manual for the examination and processing of human semen, Sixth Edition
- Calvert JK et al., Fertil Steril 2022; 118:3410.1016