Die praktische Bedeutung der Müllerschen Fehlbildungen
Fehlbildungen des weiblichen Genitaltraktes finden wir in allen Abschnitten (Vagina, Zervix, Uterus und Eileiter), nicht selten in Kombinationen. Manche bleiben asymptomatisch, andere beeinträchtigen die reproduktive Funktion. Diese Übersicht soll Klarheit darüber schaffen, wo eine Intervention sinnvoll und wo diese zweifelhaft – da unter Umständen schädlich – ist.
Müllersche Fehlbildungen sind nicht selten. Man schätzt das Vorkommen auf ca. 5 %, bei Frauen mit Sterilität auf 8 % und bei Aborten auf 13 % [1].
Embryologie
Während der embryonalen Entwicklung werden die Müllerschen Gänge elongiert, dann fusioniert, kanalisiert und am Ende dann die Septen resorbiert. Zu allen Zeitpunkten der Entwicklung können Fehlbildungen auftreten, dementsprechend ergibt sich ein buntes klinisches Erscheinungsbild. Etwa zur gleichen Zeit und in enger Nachbarschaft entwickelt sich der Harntrakt, deshalb die häufige Assoziation Müllerscher Fehlbildungen mit Ureter- und Nierenmissbildungen.
Unabhängig davon läuft die Entwicklung der Gonaden (ab der 7. SSW). Deshalb haben betroffene Frauen fast immer normale Ovarien mit normaler Funktion.
Die Müllerschen (paramesonephrischen) Gänge differenzieren sich ab Woche 6 aus dem Coelomepithel, elongieren sich dann kaudal, überkreuzen die Wolffschen (mesonephrischen, beim Mann vollentwickelten) Gänge nach medial und fusionieren in der Mitte zum primitiven uterovaginalen Kanal. Beim Mann verhindert das Anti-Müllersche Hormon (AMH) bzw. MIF (Muellerian inhibiting factor), welches in den Sertolizellen des Hodens produziert wird, das Wachstum und die Differenzierung des Müllerschen Systems.
In Woche 10 verbindet sich das kaudale Ende der fusionierten Müllerschen Gänge mit dem Sinus urogenitalis. Als nächstes beginnt die innere Kanalisierung. Dabei entstehen zwei Kanäle durch ein Septum getrennt. Das Septum wird von kaudal her nach kranial fortlaufend resorbiert bis zur 20. Schwangerschaftswoche. Daraus entstehen Uterus und die oberen 2/3 Vagina, unfusioniert bleiben die Eileiter. Das untere Drittel der Vagina hingegen entsteht nach dem Kontakt des Müllerschen Gangsystems mit dem Sinus urogenitalis. Sinovaginale Knospen proliferieren Richtung Müllersche Gänge zur sogenannten Vaginalen Platte. Das Lumen der Vagina entsteht durch Zelldegeneration im Zentrum der Platte. Dieser Vorgang geht kaudal nach kranial und ist ebenfalls in der 20. SSW beendet. Die Hymenalmembran trennt das Vaginallumen vom Sinus urogenitalis. Die Zellen im Zentrum degenerieren meist vor der Geburt. Das Hymen persistiert als Schleimhautfalte am Introitus.
Die Ursachen der Müllerschen Fehlbildungen sind unbekannt und treten sporadisch auf. Die Auflösung der Septen entsteht zu einem späteren Zeitpunkt, zu dem die Nierenbildung bereits abgeschlossen ist, deshalb ist z. B. der Uterus septus nicht mit Missbildungen des Harnsystems assoziiert.
Die ESHRE/ESGE-Klassifikation
Die Grundlage für die ESHRE/ESGE-Klassifikation bildet die Anatomie. Uterine Anomalien werden in Hauptklassen, entsprechend ihren embryologisch entstandenen anatomischen Abweichungen, eingeteilt: U0 = normaler Uterus; U1 = dysmorpher Uterus; U2 = septierter Uterus; U3 = bikorporaler Uterus; U4 = Hemi-Uterus; U5 = aplastischer Uterus; U6 = noch nicht klassifizierte Fälle (Abb. 1). Diese Hauptklassen werden zusätzlich in Unterklassen gegliedert, welche anatomische Varianten mit klinischer Relevanz einteilen. Zervikale und vaginale Anomalien sind unabhängig davon in Unterklassen mit klinischer Bedeutung eingeteilt. Im klinischen Alltag erlaubt die ESHRE/ESGE-Klassifikation weibliche Genitalanomalien auf einfache Art und Weise zu beschreiben und zu klassifizieren (Abb. 2).
![Abb. 1. ESHRE/ESGE-Klassifikation der Uterusanomalien: schematische Darstellung (Klasse U2: innere Einbuchtung >50 % der Uteruswanddicke & Außenkontur gerade oder mit Einkerbung <50 %; Klasse U3: äußere Einkerbung >50 % der Uterus-wandstärke; Klasse U3b: Breite der Grundvertiefung an der Mittellinie >150 % der Uteruswandstärke) [Hum. Reprod., 2013, 28: 2032–2044].](/media/img/weblication/wThumbnails/02-2020-Thema-Abb-01-5d91330d-924f645a@ll.PNG)
Diagnostik
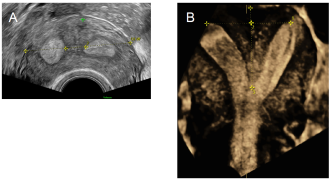
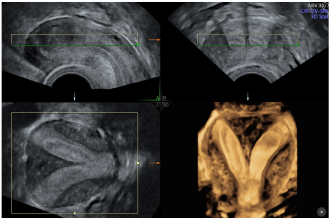
Eine uterine Malformation kann klinisch z. B. beim Vorliegen eines Vaginalseptums oder zweier Zervices vermutet werden und v. a. bei einer abdominalen oder transvaginalen Ultraschalluntersuchung (Abb. 3A). Eine präzise Beschreibung bzw. genaue präoperative Abklärung kann jedoch nur durch eine 3-D-Ultraschall- oder Kernspintomografie-Untersuchung erfolgen (Abb. 3B). Für die 3-D-Ultraschalluntersuchung werden transabdominal und v. a. transvaginale Volumenblöcke standardisiert aufgenommen und mit spezieller Software wie multiplanarer Sonographie (Abb. 4) oder OmniView (Abb. 5) mit entsprechendem 3D-Rendering untersucht. Dabei spielt die Beurteilung des Fundus uteri bzw. des Cavums eine entscheidende Rolle in der Differenzierung der verschiedenen Formen von Uterusfehlbildungen. Betrachtet man Patientinnen, bei denen eine Uterusformanomalie durch eine Hysteroskopie und allenfalls Laparoskopie bestätigt wurde (= Goldstandard), ist die Wertigkeit des 3-D-Ultraschalls zur weiteren Differenzierung einer Malformation dem MRI vergleichbar, möglicherweise sogar überlegen.
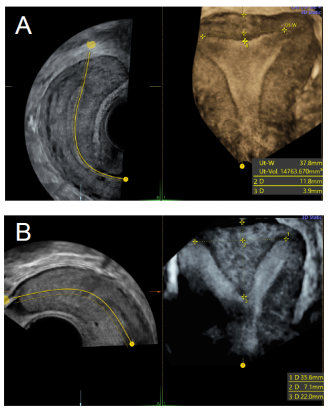
Schon vor einigen Jahren konnten wir nachweisen, dass in einer Gruppe von Frauen, bei denen eine 2-D-Ultraschall- und eine MRI-Untersuchung und dann die intraoperative Bestätigung erfolgten, die Übereinstimmung sowohl zwischen Sonografie und intraoperativem Befund als auch zwischen MRI und intraoperativem Befund nur bei 60 % lag. Verglich man allerdings Patientinnen, bei denen zusätzlich präoperativ auch eine 3-D-Ultraschalluntersuchung erfolgt war, fand sich in allen Fällen eine Übereinstimmung zwischen dem 3-D-US-Befund und dem intraoperativen Befund [2]. Weitere Studien, Übersichtsarbeiten und Metaanalysen haben bestätigt, dass es sich bei der 3-D-Ultraschalluntersuchung um eine sehr zuverlässige diagnostische Methode für uterine Fehlbildungen handelt [3]. In geübten Händen erfordert die 3-D-Untersuchung nach der Datenaufnahme von wenigen Sekunden nur eine kurze Nachbearbeitung. Damit bringt der 3-D-Ultraschall die bildgebende Diagnostik der angeborenen uterinen Fehlbildungen wieder in die Hände der Gynäkologinnen und Gynäkologen und vermeidet aufwendigere und nicht unbedingt genauere Untersuchungen wie z. B. das MRI. Des Weiteren kann dank des 3-D-Ultraschalls, bei einem Uterus ESHRE/ESGE Klasse U2b, die Länge des zu resezierenden Anteils eines Septum uteri präoperativ genauer bemessen werden, sodass die Resektion viel präziser erfolgen kann (Abb. 5B).
Wegen ihrer eng verwandten embryonalen Herkunft können Müllersche Fehlbildungen mit angeborenen Nierenanomalien assoziiert sein (von denen die einseitige Nierenagenesie am häufigsten ist). Bei ultrasonographischem Nachweis einer uterinen Fehlbildung ist eine Nierensonographie unabdingbar [4].
Klinische Bedeutung und Therapie der uterinen Fehlbildungen
Mit einer Hämatometra oder einem Hämatokolpos kombinierte Fehlbildungen (z. B.: nicht kommunizierendes rudimentäres Uterushorn, Uterus didelphys mit vaginaler oder zervikaler Agenesie (U3bC3 oder V2) verursachen Beschwerden (Dysmenorrhoe, chronische Unterbauchschmerzen) und werden meist so diagnostiziert. Die meisten Müllerschen Fehlbildungen werden aber zufällig bei Abklärungen wegen Subfertilität oder wiederkehrenden Aborten entdeckt. Insbesondere seit der zunehmend verbreiteten Anwendung der 3-D-Sonographie werden häufiger uterine Fehlbildungen diagnostiziert. Die meisten dieser Fehlbildungen müssen jedoch nicht operiert werden.
Die meisten Experten sind der Meinung, dass ein unklarer, jedoch wahrscheinlicher Zusammenhang zwischen uterinen Malformationen und negativem Einfluss auf die Fertilität besteht. Die Wirksamkeit einer chirurgischen Behandlung von nicht obstruktiven Uterusanomalien zur Verbesserung der Fortpflanzungsergebnisse, vor allem, wenn sie zufällig diagnostiziert wurden, ist jedoch nicht bewiesen und sehr umstritten.
Bei obstruktiven Anomalien ist das Ziel einer operativen Therapie von Müllerschen Fehlbildungen, die anatomischen Veränderungen so zu korrigieren, dass die Schmerzen behoben, die Lebensqualität verbessert und langfristige gesundheitliche und reproduktive Beeinträchtigungen vermieden werden.
Frauen, bei welchen eine komplexe uterine Fehlbildung diagnostiziert wurde, benötigen oft eine psychosoziale Unterstützung und Beratung, um die funktionellen und emotionalen Auswirkungen, welche die Diagnose auslösen kann, zu begleiten. Ein zukünftiger Kinderwunsch sollte mit Jugendlichen und ihren Eltern bzw. Erziehungsberechtigten besprochen werden.
Therapie der obstruktiven uterinen Fehlbildungen
Ein Uterus unicornis (ESHRE/ESGE Klasse U4b) kann mit einer Beeinträchtigung der Fertilität einhergehen. Die Lebendgeburtenraten werden mit bis zu 40 % beschrieben. Die in der Literatur angegebenen Abortraten variieren zwischen 29 % und 58 %, die Frühgeburtenraten zwischen 18 % und 44 %.
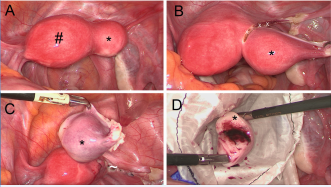
Die Therapie hängt in erster Linie von den Besonderheiten des rudimentären Horns ab (ESHRE/ESGE Klasse U4a). Liegt kein rudimentäres Horn vor, ist keine Therapie notwendig. Ist das rudimentäre Horn endometriumfrei und klein, kann ebenfalls auf eine Therapie verzichtet werden. Liegt ein kommunizierendes oder nichtkommunizierendes rudimentäres Horn mit Endometriumanteilen vor, so ist eine Entfernung notwendig. Insbesondere bei nichtkommunizierenden rudimentären Hörnern sollte dies erwogen werden, da diese Situation meist zu einer Hämatometra mit Beschwerden führen kann und mit einer hohen Inzidenz einer Endometriose einhergeht (verstärkte retrograde Menstruation), die zusätzlich die Fertilität beeinträchtigen kann (Abb. 6). Im rudimentären Horn kann sich auch eine extrauterine Schwangerschaft einnisten. Die Schwangerschaft führt oft im 2. Trimenon zur dramatischen Situation einer Uterusruptur und ist somit für die Patientin potenziell lebendbedrohend, weshalb die laparoskopische Entfernung des schwangeren rudimentären Horns notwendig ist (siehe „Im Bild“, S. 38 in diesem Heft).
Therapie der nicht obstruktiven uterinen Fehlbildungen
Die Zahl ausgetragener Schwangerschaften liegt beim Uterus bicornis zwischen 30 und 50 %. Bis zu 47 % der Schwangerschaften enden beim Uterus bicornis als Frühaborte. Es gibt jedoch auch Fallberichte, die selbst von ausgetragenen Zwillingsschwangerschaften bei Patientinnen mit einem Uterus bicornis unicollis berichten.
Die früher häufig durchgeführte abdominale Metroplastik, die durchgeführt wird um die Form der Gebärmutter wiederherzustellen, ist nur noch selten indiziert. In Ausnahmefällen (rezidivierende Aborte oder wiederholte Frühgeburten) kann die Operation erwogen werden. Es gibt jedoch keine Studien, welche einen Vorteil des operativen im Vergleich zum expektativen Vorgehen nachgewiesen haben. In einer kontrollierten Studie über 21 Frauen mit bikornualem Uterus (13 Frauen wurden nicht operiert, bei acht Patientinnen wurde eine abdominale Metroplastik durchgeführt) konnte nach der operativen Korrektur keine Verbesserung des geburtshilflichen Outcomes festgestellt werden [5].
Septierter Uterus (ESHRE/ESGE Klasse U2a-b)
Eine systematische Review über 3805 Frauen mit uterinen Fehlbildungen hat gezeigt, dass Frauen mit Uterus subseptus (ESHRE/ESGE Klasse U2a) oder Uterus Septus (ESHRE/ESGE Klasse U2b), die schlechtesten Fertilitätsergebnisse hatten. Der Uterus subseptus wirkt sich durch die erhöhte Rate früher (OR 2,89; 95 % CI 2,02–4,14) und später Aborte (OR 2,14; 95 % CI 1,48–3,11) negativ auf die Fertilität aus. Weiterhin werden vermehrt Lageanomalien (OR 6,24; 95 % CI 4,05–9,62) sowie eine erhöhte Rate an Wachstumsretadierungen, Totgeburten und Dystokien beobachtet [6]. Das Fertilitätsergebnis ist bei Frauen mit Uterus septus schlechter als bei Frauen mit Uterus subseptus.
Die pathophysiologischen Prozesse, welche die schlechten Fertilitätsergebnisse erklären würden, sind noch nicht definitiv erläutert. Es wird postuliert, dass das über dem Septum liegende Endometrium abnormal ist, wodurch es zu einer suboptimalen Implantation kommt mit anschliessend verminderter und ungenügender Blutversorgung, so dass die Plazentation und dementsprechend das Embryowachstum nicht unterstützt werden können. Unkoordinierte Uteruskontraktionen sowie eine verminderte Uteruskapazität werden ebenfalls diskutiert.
Ab wann ein Uterusseptum klinisch relevant ist, wird in der Literatur trotz neuer Nomenklatur umstritten debattiert. Eine Gruppe von international anerkannten Experten (CUME = Congenital Uterine Malformation Experts) hat kürzlich die Einteilung entsprechend den ESHRE/ESGE-Kriterien kritisiert und gezeigt, dass im 3-D-Ultraschall die ESHRE/ESGE-Kriterien zu einer 14-mal höheren Prävalenz eines Septum Uteri führen im Vergleich zur Klassifizierung entsprechend den ASRM-Kriterien [7]. Die Bedenken hinsichtlich einer Überdiagnose von Uterus subseptus wurden bestätigt, nachdem gezeigt wurde, dass es bei Frauen, bei welchen initial ein normaler Uterus im Ultraschall diagnostiziert wurde, und die Diagnose nach Anwendung der ESHRE/ESGE-Kriterien bestehen blieb, im Vergleich zur Gruppe von Frauen, bei welchen nach Anwenden der ESHRE/ESGE-Kriterien ein Septum Uteri diagnostiziert wurde, kein Unterschied im Fertilitätsoutcome gab [8]. Die CUME-Gruppe hat deshalb eine einfache und reproduzierbare Definition der Diagnose eines Uterus septus vorgeschlagen, bei welcher das Septum >10 mm in das Cavum uteri hineinragen muss (Abb. 1: Class U2a).
Es gibt keine definitiven Beweise, die eindeutig zeigen, dass bei einer Patientin mit aktuellem oder zukünftigem Kinderwunsch und der zufälligen Diagnose eines Uterus subseptus oder Uterus septus eine operative Korrektur erfolgen sollte. Dennoch sollte aufgrund der möglichen operativen Korrektur mittels Hysteroskopie (Abb. 7) eine präventive Behandlung mit der Betroffenen besprochen werden. Es gibt Hinweise, dass die operative Korrektur eines Uterus subseptus bei Sterilitätspatientinnen die Fertilität verbessert. So konnten zwei prospektive Untersuchungen zeigen, dass Frauen mit einem Uterusseptum und idiopathischer Sterilität von einer Septumdissektion profitierten [9, 10]. Vor Einleitung von Maßnahmen der assistierten Reproduktion sollte eine operative Septumdurchtrennung auf jeden Fall erfolgen.
Das uterine Septum wird in der Mitte zwischen Vorderwand und Hinterwand mit der hysteroskopischen Schere oder einer Nadelelektrode durchtrennt (Abb. 7). Von einer Schlingenresektion des Septums ist abzuraten, da hierbei unnötig Gewebesubstanz des Uterus entnommen wird. Der Eingriff sollte in der ersten Zyklushälfte bei gering proliferiertem Endometrium durchgeführt werden. Die Inzision wird soweit ausgeführt, bis eine nach subjektiven Kriterien normal erscheinende Form des Cavum uteri resultiert. Auch wenn die Länge des zu durchtrennenden Septum uteri präoperativ mittels 3-D-Ultraschall definiert wurde, ist es anzuraten, den Eingriff unter simultaner transabdominaler ultrasonographischer Kontrolle durchzuführen. Eine spezifische Nachbehandlung nach der operativen Korrektur ist nicht notwendig. Die postoperative Einlage eines Fremdkörpers (IUP, Ballonkatheter) bietet keine Vorteile, auch ist nicht bekannt, ob eine postoperative medikamentöse Östrogenbehandlung sinnvoll ist. Die Rate postoperativer Synechien ist gering, die intrauterine Instillation von Hyaluronsäure-Gel am Ende des Eingriffes wird jedoch empfohlen. Eine Epithelialisierung des Wundgebietes mit normalem Endometrium entsteht innerhalb von etwa drei Monaten, eine sichere Antikonzeption ist für die Dauer dieser Heilungsphase ratsam.
Die Bedeutung des Uterus arcuatus (ESHRE/ESGE Klasse U1c, als Entität nicht mehr aufgeführt) oder des dysmorphen Uterus (ESHRE/ESGE Klasse U1a-b) für die Reproduktion wird kontrovers diskutiert. Es gibt keine Daten, die zeigen, ob bei einer Patientin mit aktuellem oder zukünftigem Kinderwunsch und der zufälligen Diagnose eines Uterus ESHRE/ESGE Klasse U1a-c eine operative Korrektur erfolgen sollte. Es fehlen ebenfalls Daten, ob durch die operative Korrektur dieser uterinen Fehlbildungen bei Sterilitätspatientinnen die Fertilität verbessert wird.
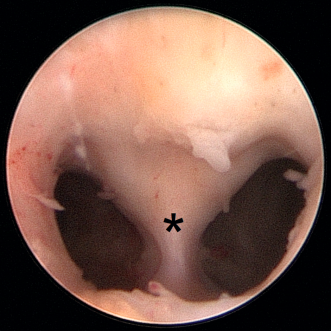
Fehlbildungen der Zervix
Diese sind ebenso selten (1/80 000–1/100 000) wie schwierig zu behandeln [11]. In 50% der Fälle sind sie assoziiert mit einer Vaginalatresie. Therapieziele sind die Beseitigung der Symptome einer Abflussbehinderung (Obstruktion durch Zervixatresie oder Hyperplasie), Ermöglichung einer Sexualfunktion (z.B. durch eine Neovagina) und möglichst Erhaltung des Uterus (Fertilitätserhaltung). Je nach Art der Anomalie (Zervixaplasie oder Hyperplasie, normale Vagina oder Agenesie) ist die operative Wiederherstellung von Form und Funktion eine grosse Herausforderung mit häufigen Komplikationen (Reokklusion der Zervix, Infektionen).
Bei Zervixaplasie und Hämatometra kann es deshalb bei jungen Frauen ein Weg sein, eine mit Komplikationen behaftete Chirurgie aufzuschieben und z.B. durch kontinuierliche Gabe von Ovulationshemmern ohne Pause Zeit zu gewinnen.
Wenn chirurgische Schritte scheitern, ist oft die Hysterektomie die letzte heilende Massnahme.
Vaginalanomalien
Quere Septen und ein Hymen imperforatum sind meist mit anderen Müllerschen Missbildungen assoziiert, können aber erhebliche Auswirkungen auf das reproduktive Potenzial haben. Bei primärer Amenorrhoe sollte man frühzeitig daran denken.
Ein queres Septum ist die Folge eines Fusionsdefektes zwischen urogenitalem Sinus und Müllerschem Gang und erfordert nach Resektion des Septums eine Reanastomisierung zwischen Vagina und Introitus. Longitudinale Septen müssen nur bei entsprechenden Symptomen entfernt werden (Dyspareunie). Gelegentlich werden sie erst in der fortgeschrittenen Geburtsphase festgestellt. Nach Durchtrennung ist die vaginale Geburt meist instantan.
Vaginalagenesie
Diese bei 1:5000 auftretende Anomalie (Mayer-Rokitansky-Küster-Hauser-Syndrom) haben wir bereits detailliert in unserer Zeitschrift abgehandelt (Frauenheilkunde Aktuell 2007;1:4–12).
Literatur
1. Chan YY, et al. Hum.
Reprod. Update 2011;17:761–71.
2. Imboden
S., et al. Ultraschall Med 2014;35:440–4.
3. Kougioumtsidou A, et al. Arch Gynecol Obstet
2019;299:779–89.
4. Heinonen PK. Eur J Obstet Gynecol Reprod
2016;206:141–6.
5. Maneschi F, et al. Acta EurFertil
1993;24:117–20.
6. Fox NS, et al. J Matern Fetal Neonatal Med
2014;27:949–53.
7. Ludwin A, et al. Hum. Reprod. 2015;30:569–80.
8. Knez J, et al. Hum. Reprod. 2018;33:600–6.
9. Mollo A, et al. Fertil Steril 2009;91:2628–31.
10. Pabuccu R, et al. Fertil Steril 2004;81:1675–8.
11. Mikos T, et al. Fertil
Steril 2020;113:723.

