Im Bild: Uterine arterio-venöse Malformationen: eine Fallserie aus Bern
Wie bereits im erschienenen Beitrag „Plazentapolypen und andere vaskuläre, uterine Tumoren“ der FHA 2/18 beschrieben, stellen arterio-venöse Malformationen (AVM) eine wichtige Differentialdiagnose der uterinen Gefässtumoren dar [1].
Bei uterinen AVM handelt es sich um anormale Verbindungen zwischen Arterien und Venen ohne dazwischengeschaltetes Kapillarbett.
Bisher wurden in der Literatur nur wenige hundert Fälle beschrieben. Da viele solcher Malformationen asymptomatisch sind, besteht wahrscheinlich eine hohe Dunkelziffer. Im Folgenden berichten wir über eine Serie von Fällen, welche in unserer Klinik diagnostiziert und behandelt worden sind.
Fall 1
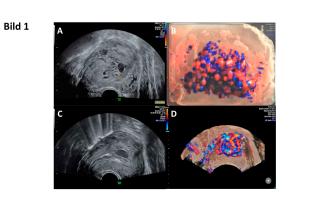
31-jährige 2101 mit St. n. medikamentöser Abortinduktion bei Missed abortion in der 9. Schwangerschaftswoche. Vorstellung im gynäkologischen Ambulatorium wegen übermensstarker Blutung. Vaginalsonographisch zeigt sich in der Standardsonographie sowie im Farbdoppler ein pathologisches Bild. Das Myometrium ist durchsetzt mit „Lakunen“, v. a. im Bereich der Hinterwand (Abb. 1A). Im Farbdoppler finden wir eine massive, komplexe Durchblutung mit arteriovenösen Geflechten (Abb. 1B), welche durch beide Aa. uterinae gespiesen werden.
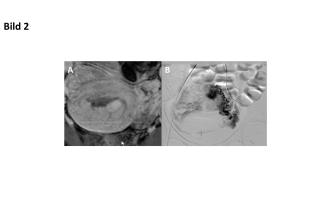
Verschiedene Optionen werden diskutiert. Letztendlich entscheiden wir uns zu einer Behandlung mit Cerazette mit regelmässigen klinischen sowie sonograhischen Verlaufskontrollen. Unter dieser Therapie kommt es zu einer Abnahme der myometralen Durchblutung innerhalb von zwei Monaten. Jedoch entwickelt sich in der Hinterwand – angrenzend an das Cavum uteri – eine Gefässausbuchtung von 15 × 11 × 17 mm (Abb. 1C und D). In Anbetracht dieses grossen Aneurysmas sowie rezidivierenden, mensstarken und anämisierenden Blutungen entscheiden wir uns, radiologisch interventionell vorzugehen. Im Angio-MRI wird eine AVM bestätigt (Abb. 2A). Es erfolgt eine selektive Embolisation beider Aa. uterine (Abb. 2B).
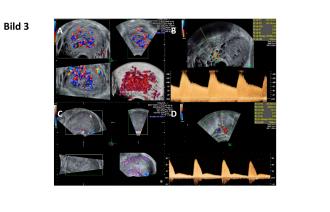
Postinterventionell lassen sich sonographisch deutlich langsamere Flussraten feststellen. Auch das Aneurysma zeigt sich etwas grössenregredient (Abb. 3A und B). Dieser Trend hält an und als Hinweis der progressiven Reduktion des entsprechenden Gefässbettes nimmt die Pulsatilität in der Aa. uterinae stetig zu (Abb. 3C und D).
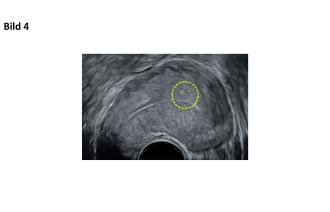
Eine Woche später ist dieses thrombosiert. Sechs Wochen nach Embolisation lässt sich keine Mehrdurchblutung im Myometrium mehr nachweisen und auch das Aneurysma lässt sich nur noch erahnen (Abb. 4).
Fall 2
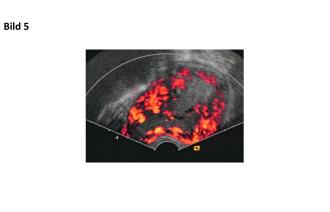
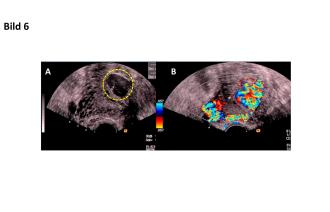
30-jährige Nullipara mit Vorstellung bei invalidisierenden UB-Schmerzen sowie Meno-Metrorrhagien. Anamnestisch ist zu erheben, dass sie bereits seit 15 Jahren an z. T. zyklusunabhängigen Unterbauchschmerzen, Dysmenorrhoe sowie an Zwischenblutungen leidet. Sonographisch zeigt sich eine AVM des Uterus mit hohen Flussgeschwindigkeiten in der Aa. uterinae (Abb. 5). Eine Embolisation der Aa. uterinae beidseits wird durchgeführt. Nach dem Eingriff leidet die Patientin weiterhin an UB-Schmerzen. Intrauterin hat sich zwischenzeitlich ein Aneurysma ausgebildet (Abb. 6A). Die uterine Durchblutung scheint des Weiteren sogar zugenommen zu haben (Abb. 6B). Nach ausführlicher Aufklärung wünscht die Patientin die laparoskopische Hysterektomie. In der histologischen Aufarbeitung wird die AVM von 5 cm im Durchmesser bestätigt.
Fall 3
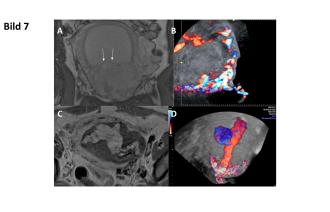
38-jährige 3102 mit St. n. Fetocid sowie MTX-Gabe bei Sectionarben-Schwangerschaft in der 14. SSW. Im Verlauf kommt es zur Geburt des Fetus, die Plazenta befindet sich jedoch noch in utero. Im MRI zeigt sich der V. a. eine Plazenta percreta mit möglicher Infiltration der Harnblase (Abb. 7A, Pfeil). Sonographisch kann dies nicht bestätigt werden. Die frühe Plazenta invadiert jedoch das Myometrium in Form einer Plazenta increta. In den Verlaufskontrollen lässt sich eine zunehmende Vaskularisation der Uterusvorderwand (Abb. 7B) nachweisen. Es wird der Entscheid zur Embolisation der Aa. uterinae links gefasst. Die Intervention muss bei Thoraxschmerzen vorzeitig abgebrochen werden. Die intrauterine Masse als auch die intramurale Durchblutung zeigen sich postinterventionell im MRI sowie sonographisch wenig reduziert (Abb. 7C und D). Bei anhaltend vaginalen Blutungen Entscheid zur LSC Hysterektomie, histologisch Plazenta accreta.
Fall 4
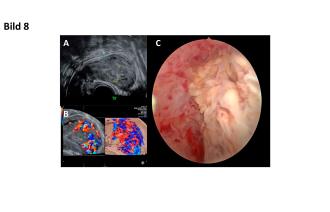
38-jährige 4301 mit St. n. medikamentöser Therapie bei Missed abortion in der 8. SSW. In der Nachkontrolle lassen sich Restmaterial im Cavum sowie eine Hypervaskularisation des Uterus erkennen (Abb. 8A und B). Das B-HCG beträgt 47 U/l. Sonographisch besteht der V. a. eine AVM. Differentialdiagnostisch lässt sich ebenfalls an einen Plazentarpolypen denken. Es wird der Entscheid zur operativen Hysteroskopie gefällt. Intraoperativ lässt sich im Bereich des Fundus als auch an der linken Seitenwand eine polypöse Struktur nachweisen (Abb. 8C). Es erfolgt die Resektion ohne nennenswerte Blutung. Histologisch lässt sich der präoperative V. a. auf einen Plazentarpolypen bestätigen. Es ist zu erwarten, dass sich nach dessen Entfernung die Hypervaskularisation regredient zeigt.
Diskussion
AVM werden in angeborene und erworbene Formen eingeteilt, wobei die letzteren häufiger sind. Bei angeborenen AVM handelt es sich um eine anormale Endothelproliferation und verspätetes Gefäss-Remodelling während der fetalen Angiogenese. Diese erstrecken sich oftmals über den Uterus hinaus in das umgebende Becken und können umgebende Strukturen invadieren.
Erworbene AVM werden hingegen nach Operationen, nach Schwangerschaften oder nach malignen Prozessen wie Trophoblast-Tumoren (GTD), Endometrium- und Zervixkarzinom beschrieben. Sie können in der Adoleszenz oder auch postmenopausal auftreten. Klinisch zeichnen sich solche Gefässpathologien durch Blutungsstörungen wie Spotting, Menorrhagien bis hin zu kreislaufrelevanten Blutungen aus. Eine Grosszahl ist jedoch asymptomatisch.
In AVM wird der arterielle Druck direkt in das venöse System umgeleitet, welches dort zu einer erhöhten Flussgeschwindigkeit als auch zu einer Gefässerweiterung führt. Eine solche Gefässfehlbildung wird oft als Erstes im transvaginalen Ultraschall festgestellt. Ohne Farbdoppler imponieren diese uterinen Gefässtumore als tubuläre oder schwammige, echoleere bis hypoechogene Bereiche im Myometrium. Das Myometrium imponiert dadurch verdickt. Differentialdiagnostisch kommen Restmaterial nach Schwangerschaften, Hämangiome oder GTD in Frage. Mittels Doppler-Sonographie erhält man weitere wichtige Informationen. Hier lassen sich gewundene Gefässe mit unterschiedlicher Flussorientierung darstellen. Eine erhöhte Flussgeschwindigkeit in einem Niederdruck-Gefässsystem (RI zwischen 0.25 und 0.55) deutet auf eine arteriovenöse Fistel hin [2, 3]. Des Weiteren kommt es häufig zu einer Abnahme des gesamten uterinen Widerstandes und entsprechend zu einem Abfall der Pulsatilität in der Aa. uterinae sowie zu hohen Flussgeschwindigkeiten. Das Dopplerflussbild ähnelt dabei dem eines schwangeren Uterus (siehe Fall 1).
Die AVM kann im Anschluss mittels Durchführung einer digitalen Subtraktionsangiographie (DSA) bestätigt werden. Gleichzeitig besteht die Möglichkeit der Intervention im Sinne einer Embolisation. Das Management der AVM hängt primär von der Klinik, aber auch vom Alter bzw. vom Wunsch nach Fertilitätserhalt ab [4]. Die uterine peak systolic velocity (PSV) scheint eine gewisse Hilfestellung in der Entscheidungsfindung im Management einer AVM zu leisten. Bei einer Geschwindigkeit ≤ 40 cm/s besteht die Möglichkeit einer spontanen Rückbildung der Malformation. Ein abwartendes Prozedere mit regelmässigen Kontrollen bei einer Patientin mit stabilem Hb-Wert ist möglich. Bei einer PSV über 60 cm/s ist eine spontane Regression eher unwahrscheinlich und es besteht das Risiko einer signifikanten Blutung. Bei Werten zwischen 40 und 60 cm/s ist sowohl eine Regredienz als auch eine Progression möglich [5].
Bei abgeschlossener Familienplanung und Wunsch nach einer definitiven Therapie ist der Patientin die Hysterektomie zu empfehlen. Bei Kinderwunsch ist die transarterielle selektive Embolisation die Therapie der Wahl. Die ovarielle Durchblutung sollte dabei nicht beeinträchtigt, der Menstruationszyklus (ca. nach 1–5 Monaten) sowie die Fertilität wiederhergestellt werden. Bisher ist die erfolgreiche Verwendung von verschiedenen Embolisation-Agentien (Gelschaum, Coils, Polyvinyl-Alkohol etc.) beschrieben worden. Zu einem Therapie-Versagen oder Rezidiv kann es bei Fortbestehen einer oder mehrerer arterio-venösen Verbindungen kommen, was häufig eine wiederholte Embolisation notwendig macht. Zu beachten ist auch, dass durch ein mögliches Einschwemmen des Embolisationmaterials in das venöse System das Risiko einer Lungenembolie besteht. Komplikationen wie Schmerzen, Nekrose der perianalen Haut oder Entstehung einer uterovaginalen oder rectovaginalen Fistel nach Embolisation sind selten [4, 8–11]. In der Literatur werden in Fallbeispielen auch ergänzende Behandlungsmöglichkeiten mit GnRH-Agonisten, Progesteron oder Danazol bei stabilen Patienten erwähnt [6, 7].
Aufgrund der geringen Anzahl an Fallbeschreibungen von Schwangerschaften nach Embolisation bleibt das genaue Risiko für Komplikationen unbekannt. Ein gewisser Zusammenhang mit intrauteriner Wachstumsretardierung, Abort, Frühgeburtlichkeit und postpartaler Uterusatonie wird vermutet. Die Indikation zur Embolisation sollte demnach mit Bedacht gestellt werden. Studien haben hingegen kein erhöhtes Uterusruptur-Risiko gezeigt. Eine vaginale Entbindung ist also möglich [12, 13].
AVM können ebenfalls in Zusammenhang mit Plazentarpolypen vorkommen. Bezugnehmend auf den bereits zu Beginn erwähnten Artikel „Plazentapolypen und andere vaskuläre, uterine Tumoren“ erwägen wir die hysteroskopische Resektion bei Plazentapolypen als geeignete Therapie [1]. Im Rahmen eines Plazentapolypen mit gleichzeitig bestehender AVM empfehlen wir bei Kinderwunsch und stabiler Patientin die Behandlung mit Methotrexat oder ggf. ein exspektatives Vorgehen (bei möglicher spontaner Regredienz). Ist die Familienplanung abgeschlossen, kann eine Embolisation oder Hysterektomie erwogen werden [14].
Aufgrund der geringen Fallzahl war es bisher nicht möglich, einen klaren Behandlungsalgorithmus zu entwickeln. Ausschlaggebend und wegweisend sind jedoch die Klinik und der mögliche Wunsch nach Fertilitätserhalt. Bei Patientinnen mit behandlungsbedürftigem Beschwerdebild und Kinderwunsch gilt nach wie vor die Embolisation als Therapie der Wahl. Es bedarf aber weiterer Studien, welche die möglichen Nebenwirkungen und Konsequenzen untersuchen als auch die Wirksamkeit der Embolisationsmaterialien miteinander vergleichen sowie die Durchführung einer einseitigen bzw. beidseitigen Embolisation gegenüberstellen.
Literatur
1. Frauenheilkunde aktuell, Ausgabe 02/2018, Artikel: Plazentapolypen und andere vaskuläre, uterine Tumore. S. 20–22
2. Huang W, Uegaki M, Thurston WA, et al. Uterine arteriovenous malformations: gray-scale and Doppler US features with MR immaging correlazion. Radiology 1998
3. Mungen E, Yergok YZ, Ertekin AA, Ergur AR, Ucmakli E, Aytaclar S: Color Doppler sonographic features of uterine arteriovenous malformations; report of two cases. Ultrasound Obstet Gynecol 1997
4. Annaiah T. K., Sreenivasan S. K.: Uterine arteriovenous malformations: clinical implications. The Obstetriscian & Gynaecologist 2015
5. Timor-Tritsch IE, Haynes MC, Monteagudo A, et al. Ultrasound diagnosis and management of acquired uterine enhanced myometrial vascularity/arteriovenous malformations. Am J Obstet Gynecol. 2016
6. Nonaka T, Yahata T, Kashima K, Tanaka K. Resolution of uterine arteriovenous malformations and successful pregnancy after treatment with a gonadotropin-releasing hormone agonist. Obstet Gynecol. 2011
7. Takeuchi K., Yamada T, Iwasa M, Mauro T. Successful medical treatment with danazol after failed embolization of uterine arteriovenous malformation. Obstet Gynecol. 2003
8. Sridhar D., Vogelzang R. L.: Diagnosis and Treatment of Uterine and Pelvic Arteriovenous Malformations: Endovascular Today 2018
9. Stancato-Pasik A, Mitty HA, Richard HM 3rd, Eshkar N. Obstetric embolotherapy: effect on menses and pregnancy. Radiology 1997
10. Yang JJ, Xiang Y, Wan XR, Yang XY. Diagnosis and Management of uterine arteriovenous fistulas with massive vaginal bleeding. Int J Gynaecol Obstet 2005
11. Descarges G, Maauger Tinlot F, Douvrin F, Clavier E, Lemoine JP, Marpeau L. Menses, fertility and pregnancy after arterial embolization for the control of postpartal haemorrhage. Hum Reprod 2004
12. Brown RL, Van Moore A, Smythe AR. Arteriographic management of uterine arteriovenous fistulas. Am J Obstet Gynecol 1986
13. Eling R, Kent A, Robertson M. Pregnancy after uterine arteriovenous malformation: case series and literature review. Australasian Journal of Ultrasound in Medicine 2012
14. Ishibara T. et al. Differential diagnosis and management of placental polyp and uterine arteriovenous malformation: Case reports and review of the literature. Womens Health 2016; 12:538–43
