Das Fruchtwasser
Das Leben entsteht aus oder in einem Tropfen Hyaluronsäure (HA). HA ist ein Glykosaminoglycan, welches einen wichtigen Bestandteil der extrazellulären Matrix ausmacht. Darin können sich die Zellen teilen, bewegen und im Rahmen der Ausreifung diese simple Grundsubstanz langsam mit komplexeren Molekülen ersetzen. Die herausragende Eigenschaft der HA ist ihre Fähigkeit, enorme Mengen an Flüssigkeit zu binden und auch das nötige Umfeld für eine Zell-Zell Kommunikation zu bilden. Diese hohe H2O-Bindungsfähigkeit verleiht den vulnerablen, noch pluripotenten Zellen auch einen mechanischen Schutz. Was hat das denn mit Fruchtwasser zu tun? Eigentlich recht wenig. Wenn man aber bedenkt, dass die wässrige Umgebung schon von Anfang an zu unserem Habitat gehört, dann sehr viel.
Ich habe mich im Rahmen eines Auslandaufenthaltes viel mit der HA auseinandergesetzt, wo ich die Zusammensetzung der Wharton’schen Sulze der Nabelschnur untersucht hatte, insbesondere bei Feten mit Down Syndrom. Dabei habe ich gelernt, dass wenn sich eine Substanz oder Struktur im Verlaufe der Entwicklung ändert, so ändert sich auch seine Funktion. Scheine in Rebus zu schreiben! Nun, die Auflösung ist klar. Das Fruchtwasser hat verschiedene, allesamt vitale Funktionen im Rahmen unserer Entwicklung. Tabelle 1 fasst diese zusammen, wertet aber nicht den gestationsbedingten Unterschied der einzelnen Teilaspekte.
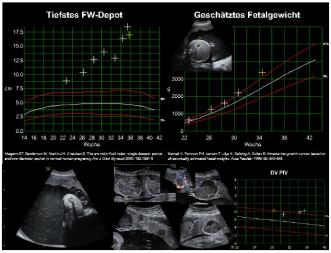
Eine der auffälligsten und einfach zu erfassenden Veränderungen des Fruchtwassers ist dessen Menge. Tabelle 2 und Grafik 1 spiegeln die durchschnittliche Fruchtwassermenge in Abhängigkeit vom Gestationsalter wider.
Das Fruchtwasser nimmt kontinuierlich zu und fällt gegen Termin wieder ab. Diese Fluktuationen sind sehr komplex geregelt und in ihrer Gesamtheit noch wenig verstanden. Dies hat u. a. auch damit zu tun, dass diese Flüssigkeits- und Elektrolytverschiebungen (v. a. Natrium und Chlorid) in und aus der Amnionhöhle (Grafik 2) über mindestens acht Wege erfolgt (Tabelle 3).

Nicht all diese Wege sind gleich relevant. Die intramembranöse Absorption von Fruchtwasser und Elektrolyten erfolgt über das Amnion auf der Plazentaoberfläche in die darunterliegenden fetalen Gefässe. Dem gegenübergestellt ist der transmembranöse Austausch, welcher zwischen dem Amnion und dem Chorion laeve stattfindet. Dieser ist v. a. in der späteren Schwangerschaft nur marginal ausgeprägt. Ähnlich sieht es mit dem Austausch über die fetale Haut aus. Mit zunehmender Keratinisierung nimmt auch dieser Anteil im Verlaufe der Schwangerschaft rapide ab. Auch der Austausch von Flüssigkeit zwischen der Nabelschnur, den darin verlaufenden Nabelschnurgefässen und der Amnionflüssigkeit unterliegt einem erheblichen, gestationsaltersabhängigen Verhalten. Wahrscheinlich spielt die Austauschfläche im ersten Trimenon eine wichtigere Rolle als später, wenn die Hüllsubstanz der Nabelschnur an Menge zunimmt und damit die Diffusionsdistanz zwischen Amnion und den Gefässen grösser wird. Der höhere Nabelschnur-Coilingindex im ersten Trimenon und die kaum vorhandene Wharton’sche Sulze machen aus der Nabelschnur eine ideale Resorptionsfläche. Letztendlich wird die grösste Menge an Flüssigkeit und Elektrolyten über die Hauptwege renale Ausscheidung, Schlucken, Lungensekretion und intramembranöse Resorption beschritten, zumindest in der späteren Schwangerschaft. Der intramembranöse Transport erfolgt über eine Art unidirektionale zelluläre Transzytose von der Fruchthöhle in die fetalen Gefässe. Dieser Prozess ist interessanterweise abhängig von angiogenen Faktoren wie z. B. dem VEGF.
Störungen der Fruchtwassermenge
Es ist naheliegend, dass solche komplexen Mechanismen anfällig sind auf äussere Stimuli, metabolische Einflüsse sowie fetale Fehlbildungen. Störungen der Fruchtwassermenge können sich als zu viel (Polyhydramnie) oder zu wenig Fruchtwasser (Oligohydramnie) manifestieren. Die Fruchtwassermenge wird sonographisch entweder anhand des grössten Depots in vier Quadranten definiert oder als Summe von vier Messungen in den vier Quadranten. Letzterer Wert wird auch als Amniotic fluid index (AFI) bezeichnet. Ich bevorzuge die Messung des grössten Depots. Damit läuft man auch weniger Gefahr, eine Oligohydramnie zu häufig zu diagnostizieren, insbesondere am Termin. Dies wurde auch in Metaanalysen von randomisierten Studien untersucht.

Ein Polyhydramnion wird definiert als grösstes Depot >8 cm (oder AFI >24 cm). Etwa 1 % aller Schwangerschaften weisen zu viel Fruchtwasser auf. Das Schwangerschaftsoutcome ist in dieser Subgruppe von Fällen kompliziert durch eine erhöhte Frühgeburtlichkeit, einen vorzeitigen Blasensprung, Plazentalösung, fetale Lageanomalien sowie eine erhöhte Sectio- und Atonierate. In Tabelle 4 sind die wichtigsten fetalen/neonatalen Implikationen zusammengefasst. Wie daraus ersichtlich ist, sind eine detaillierte Anamnese und sorgfältige Untersuchung von Mutter und Fetus bei Polyhydramnion imperativ. Bei den Fällen, wo man keine Ursache findet, muss postnatal das Kind ebenfalls sorgfältig untersucht werden. So konnten Abele et al. zeigen, dass in etwa 40 % der „idiopathischen Polyhydramniefälle“ postnatal 10 % dieser Kinder noch Fehlbildungen aufwiesen. Je ausgeprägter das Polyhydramnion ist, desto wahrscheinlicher liegt eine strukturelle (oder andere) Fehlbildung vor. Desgleichen die Kombination von kleinem Kind und Polyhydramnion, insbesondere, wenn sich das Polyhydramnion mit zunehmendem Gestationsalter progressiv verhält. In eigenen Untersuchungen von Schwangerschaftsverläufen von Frauen mit Suchtproblematik konnte gezeigt werden, dass die Inzidenz von Polyhydramnie beinahe 20 % betrug bei einem mittleren Geburtsgewicht der Kinder von 2600 g (unpublished data). Opiate und andere zentral sedierende Medikamente/Drogen können das Schluckverhalten der Feten und deren intestinale Motorik beeinflussen. Die Beispiele 1–4 sind Fälle mit poliurischem oder mal-resorptivem Polyhydramnion. Beim diabetischen Polyhydramnion sieht man selten solche exponenziellen Verläufe der Fruchtwassermenge und die Fruchtwasser-Depots liegen meist <10 cm. Ein Screening nach Infektionen ist nicht notwendig bei isoliertem Polyhydramnion. Falls z. B. Hinweise auf eine fetale Anämie vorliegen (Beschleunigung der Blutflussgeschwindigkeit in der A. cerebri media), kann gezielt nach einem Parvo-B19-Infekt gesucht werden.
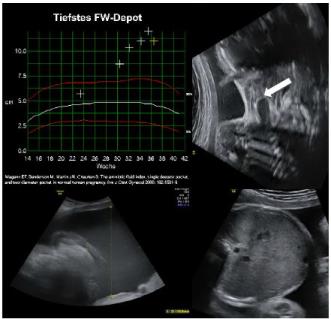
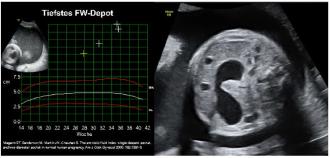
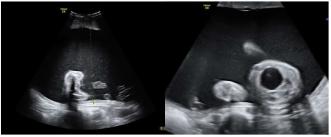
Ein Oligohydramnion ist definiert als grösstes Depot <2 cm oder AFI <5 cm. Die Differentialdiagnose ist in diesen Fällen um einiges einfacher, als wenn zu viel Fruchtwasser vorliegt. Der häufigste Grund ist ein Blasensprung, welcher meist klinisch einfach zu verifizieren ist. Bei okkulten Blasensprüngen helfen heutzutage biochemische Testverfahren aus dem vaginalen Sekret. Eine Instillation von Indigocarmin in die Fruchthöhle, um einen Blasensprung auszuschliessen, ist nicht mehr notwendig. Eine Störung der Urinproduktion stellt den Beweis dar, dass die renale Funktion ganz wesentlich mit der Regulation der Fruchtwassermenge gekoppelt ist. Klassisch ist die Anhydramnie im 2. Trimenon im Falle einer bilateralen Nierenagenesie, -dysplasie oder Obstruktion der Urethra (Klappen oder Agenesie). Zuletzt sind medikamentös induzierte Schädigungen der Nierenfunktion wie z. B. durch das Angiotensin konvertierende Enzym (ACE-Hemmer) und die Angiotensin-II-Rezeptor-Blocker (ARB) im 2. und 3. Trimenon zu nennen. Beide führen zu einer Hypoperfusion der fetalen Nieren mit konsekutiver Reduktion der Urinproduktion. Eine direkte Störung der Nierenfunktion wird auch durch den Prostaglandininhibitor Indometacin induziert. Indometacin wird v. a. in den Staaten als Tokolytikum eingesetzt und kann bei prolongiertem Einsatz zu Oligohydramnie führen über eine Beeinflussung des Renin-Angiotensin-Systems und auch über eine direkte, konstringierende Wirkung v. a. auf die Aa. renales. Diese Niereninsuffizienz ist meist reversibel und deswegen wurde Indometacin auch zur Behandlung von polyurischer Polyhydramnie eingesetzt. Die Literatur ist diesbezüglich etwas kontrovers, kann aber in ausgesuchten Fällen versucht werden. Dabei wurden Dosen von 2.2–3 mg/kg KG oder 3–4× 25 mg tgl. verabreicht. Nach 32 Wochen muss auch der Ductus arteriosus monitorisiert werden, da unter NSAR auch ein vorzeitiger Verschluss induziert werden kann.
Die Plazentainsuffizienz ist ein wichtiger Faktor für Oligohydramnie. Am Termin könnte die Detektion eines Oligohydramnions helfen, die „verpassten“, kleingewachsenen Kinder zu erfassen und somit die Rate an fetal distress oder gar intrauterinem Fruchttod zu reduzieren. Wichtig dabei sind die diagnostischen Kriterien eines Oligohydramnions am Termin! Das grösste Depot <2 cm weist die beste Performance auf, um unnötige Interventionen zu verhindern. Die Dopplersonographie ist das diagnostische Instrument, um eine fetale Umverteilung auch der renalen Perfusion zu erfassen.
Literaturangaben
1. Brace RA. Physiology of amniotic fluid volume
regulation. Clin Obstet Gynecol 1997;40:280–289
2. Brace RA et al. Regulation of amniotic fluid
volume: evolving concepts. In Zhang L and C.A. Ducsay (eds.), Advances in Fetal
and Neonatal Physiology, Advances in Experimental Medicine and Biology. 2014;
814
3. Brace RA et al. Normal amniotic fluid volume
changes throughout pregnancy. Am J Obstet Gynecol 1989;161:382–388
4. Gilbert WM et al. Amniotic fluid volume and
normal flows to and from the maniotc cavity. Semin Perinatol 1993;17:150–157
5. Morris RG et al. Association and prediction of
amniotic fluid measurement for adverse outcome: systematic review and
meta-analysis. BJOG 2014;21:686–699
6. Nabhan AF et al. Amniotic fluid index versus
single deepest vertical pocket: a meta-analysis of randomized controlled
trials. Int J Gynaecol Obstet.2009 Mar;104(3):184–8
7. Kenneth J et al. Toward consistent terminology:
Assessment and reporting of amniotic fluid volume. Semin Perinatol
2013;37:370–374
8. Magann EF et al. A review of idiopathic
hydramnios and pregnancy outcomes. Obstet Gynecol Surv. 2007 Dec;62(12):795–802
9. Abele H et al. Idiopathic polyhydramnions and
postnaltal abnormalities. Fetal Diagn Ther 2012;32:251–255
10. Pri-Paz S et al. Maximal amniotic fluid index
as a prognostic factor in pregnancies complicated by polyhydramnios. Ultrasound
Obstet Gynecol. 2012; 39(6):648–53
11. Hara K et al. Clinical features of
polyhydramnios associated with fetal anomalies. Congenit Anom (Kyoto).
2006;46(4):
177–9
12. Fayyaz H et al. TORCH screening in
polyhydramnios: an observational study. J Matern Fetal Neonatal Med. 2012
Jul;25(7):1069–72.
13. Pasquini L et al. Prevalence of a positive
TORCH and parvovirus B19 screening in pregnancies complicated by
polyhydramnios. Prenat Diagn. 2016;36(3):290–3
14. Palacio M et al. Meta-analysis of studies on
biochemical marker tests for the diagnosis of premature rupture of membranes:
comparison of performance indexes. BMC Pregnancy Childbirth;2014;14:183.
15. Enzensberger C et al. Course and outcome of
pregnancy after maternal exposure to angiotensin-II-receptor blockers--case
report and review of the literature. Ultraschall Med. 2012;33(5):493–6
16. Abou-Ghannam G et al. Indomethacin in pregnancy:
applications and safety. Am J Perinatol. 2012;29(3):175–86.
17. Abhyankar S et al. Indomethacin therapy in
hydramnios. J Postgrad Med. 2000; 46(3):176–8
