Hormone und Krebs
Nachdem Anfang der 2000er nach Veröffentlichung der WHI- Studie die Hormonersatztherapie zunächst in Verruf geraten war, ging der Einsatz von Hormonen stark zurück.
Nach kritischer Auseinandersetzung mit der Thematik und weiteren vielfachen Analysen hat sich die Situation wieder beruhigt und es wird generell die Meinung vertreten, dass der Nutzen einer Hormonersatztherapie bei (peri-)menopausalen symptomatischen Frauen die Risiken überwiegt. Im Folgenden findet sich eine Zusammenstellung verschiedener Malignome aus dem gynäkologischen Bereich sowie deren Risikomodifikation durch verschiedene hormonelle Faktoren.
Malignome des Genitaltraktes
Auch bei Malignomen des Uterus und des Ovars können endokrine Faktoren eine Rolle spielen. Dies ist vielen Kollegen aufgrund der geringeren Prävalenz dieser Erkrankungen weit weniger bewusst als beim Mammakarzinom. Eine klinische Relevanz besteht für den klinischen Alltag jedoch durchaus. Gerade das Endometriumkarzinom wird aller Voraussicht nach eine Inzidenzsteigerung erfahren, wenn sich der in den USA beobachtete Trend auch in Europa einstellt.
Endometriumkarzinom
Adipositas stellt bekanntermassen einen wichtigen Risikofaktor für die Entwicklung eines Endometriumkarzinoms (Typ-I-Karzinom) dar. In den USA hat dieser Umstand dazu geführt, dass insbesondere bei jungen Frauen die Inzidenz dieser Erkrankung in den letzten Jahren erheblich zugenommen hat [1]. Dies ist vorrangig auf die endogene Östrogenproduktion zurückzuführen, die durch Aromatisierung von Androstendion zu Estron im Fettgewebe zu Stande kommt. Die Stimulation des Endometriums durch die Östrogendominanz führt über Hyperplasien mit Atypien schliesslich zur Karzinomentstehung. Gleichzeitig können im Rahmen der Adipositas jedoch auch andere endokrine Faktoren eine Rolle spielen, etwa Apokine wie das Leptin. Auch diese erhöhen das Karzi- nomrisiko, und zwar vermutlich nicht nur für das Endometriumkarzinom. Adipositas führt in vielen Fällen zu einem metabolischen Syndrom mit diabetischer Stoffwechsellage. Eine Insulinresistenz, wie sie für den Diabetes mellitus Typ II kennzeichnend ist, wurde als unabhängiger Risikofaktor für die Entstehung eines Endometriumkarzinoms identifiziert [2]. Hyperinsulinismus führt zu einer verminderten Synthese von SHBG (Sexual-Hormon bindendem Globulin), stimuliert die Androgenproduktion des ovariellen Kortex, die dann wiederum über die Aromatase des Fettgewebes in Östrogene umgewandelt werden. So wird die Östrogendominanz bei Adipositas über die Insulinresistenz sekundär noch verstärkt. Darüber hinaus scheint es auch einen direkten proliferativen Effekt von Insulin auf das Endometrium zu geben [3]. Die Adipositas mit ihren metabolischen Folgen stellt also eine erhebliche Risikokonstellation dar. Eine Life-Style Intervention kann sich im Sinne einer Prävention auszahlen: es konnte gezeigt werden, dass der gezielte Gewichtsverlust zu einer relevanten und statistisch signifikanten Risikoreduktion für die Entstehung eines Endometriumkarzinoms führt [16]. Die Rolle von Schilddrüsenfunktionsstörungen in der Entstehung des Endometriumkarzinoms ist nicht abschliessend ge- klärt. Bei Endometriumkarzinom-Patientinnen finden sich gehäuft erhöhte TSH-Werte, welche auch einen ungünstigen prognostischen Faktor darstellen. Der genaue Pathomechanismus ist diesbezüglich jedoch noch unklar. Es bestehen diverse Koassoziationen wie z.B. mit dem Vorhandensein eines metabolischen Syndroms [4].
Wie sieht es mit exogen zugeführten Hormonen aus? Orale Kontrazeptiva reduzieren das Risiko für die Entstehung eines Endometriumkarzinoms [5, 6], und zwar um ca. 20–40 % je nach Dauer der Anwendung, eine Langzeitanwendung ab zehn Jahren führt zur stärksten Risikoreduktion. Dieser Schutz-Effekt persistiert auch Jahrzehnte nach Absetzten des Präparates. Weniger einheitlich als die prämenopausale Hormongabe stellt sich die postmenopausale Hormonersatztherapie (HRT) in ihrem Risikoprofil dar. Nach der Menopause ist die Östrogen-Monotherapie mit einem bis zu dreifach erhöhten Risiko für ein Endometriumkarzinom vergesellschaftet. Bei einer Anwendung von über zehn Jahren wird sogar ein zehnfach erhöhtes Risiko vermutet [7–12]. Die kontinuierliche- kombinierte HRT ist dagegen mit einer Risikoreduktion vergesellschaftet [13], falls sie weniger als fünf Jahre zum Einsatz kommt, eine Langzeitanwendung ist dagegen vermutlich mit einem erhöhten Risiko verbunden, wobei diesbezüglich unterschiedliche Studienergebnisse vorliegen [10, 11]. Der Body-Mass-Index (BMI) der Patientinnen scheint auch in diesem Kontext eine besondere Rolle zu spielen: die kombinierte HRT kann bei Vorliegen einer Adipositas das Risiko erheblich senken. Bei einem BMI von 42 kg/m2 wird das Risiko von 9 auf 2.4 gesenkt [14]. Die sequentielle kombinierte HRT unter fünf Jahren wird als sicher erachtet, bei einer Anwendung von zehn Jahren und mehr liegen teils widersprüchliche Ergebnisse vor. Grundsätzlich scheinen Dauer (mind. 12 Tage/ Monat), Art und Dosis der Gestagenanwendung eine Rolle zu spielen. Zur Anwendung einer HRT bei Status nach Endometriumkarzinom gibt es wenige Daten. Typ-I-Karzinome exprimieren in der Regel Östrogen- rezeptoren (ER) und Progesteronrezeptoren (PR), sodass der gesunde Menschenverstand eine Hormongabe eigentlich verbieten würde. Interessanterweise gibt es eine Metaanalyse, die für die kombinierte HRT bei Status nach Endometriumkarzinom sogar einen protektiven Effekt für ein Rezidiv zeigt, während die Östrogen-Monotherapie keine Einfluss auf das Rezidivrisiko hatte [15]. Im Einzelfall ist die Anwendung einer HRT daher wohl zu vertreten, allerdings sollte eine eingehende Risikoaufklärung erfolgen.
Ovarialkarzinom
Auch für das Ovarialkarzinom ergeben sich einige wichtige Assoziationen mit endokrinen Faktoren. Die meisten Daten liegen diesbezüglich für invasiv-epitheliale, nicht muzinöse Ovarialkarzinome vor. Im Folgenden beziehen sich sämtliche Angaben daher auch auf diese histopathologischen Subtypen. Die Rolle der Adipositas mit ihren metabolischen Veränderungen wird beim Ovarialkarzinom kontrovers diskutiert. In einigen Studien wurde die Adipositas als Risikofaktor eingestuft, in anderen liessen sich dagegen keine signifikanten Assoziationen beobachten [17]. Die Datenlage ist hier also deutlich unklarer als beim Endometriumkarzinom. Die Einnahme oraler Kontrazeptiva reduziert das Risiko für ein Ovarialkarzinom um ca. 40 % [18]. Dieser Effekt ist ähnlich wie beim Endometriumkarzinom abhängig von der Einnahmedauer. Die Risikoreduktion persistiert auch hier noch Jahrzehnte nach dem Absetzen und betrifft alle histopathologischen Subtypen bis auf muzinöse Tumoren [19]. Meta- analysen zeigten eine Steigerung des Ovarialkarzinomrisikos bei Anwendung einer HRT in der Menopause. Hierbei ist nach wie vor nicht vollständig klar, ob es einen relevanten Risikounterschied zwischen einer Östrogen-Monotherapie und einer Kombinationstherapie gibt. In einer randomisierten WHI-Studie war das Risiko im Kombinations-Arm mit 1,58 gegenüber der Placebogabe erhöht, dieser Effekt war jedoch nicht signifikant [20]. In der Million Women Study war das relative Ovarialkarzinomrisiko nach HRT auf 1,20 erhöht, es wurden keine Unterschiede in Abhängigkeit von der Anwendungsform gefunden. Bei den epithelialen Tumoren war das Risiko seröser, aber nicht muzinöser, endometrioider oder klarzelliger Karzinome er- höht [21]. Die bisher grösste prospektive Studie mit über 900 000 Frauen zeigt sowohl für die Östrogen-Monotherapie als auch die Kombinationstherapie ein erhöhtes Risiko. Nach Absetzen der HRT gleicht sich dieses Risiko relativ schnell dem von Nicht-HRT-Anwenderinnen an [21–24].
Es liegen nur wenige Studien vor, in denen die Sicherheit einer HRT bei Patientinnen nach Ovarialkarzinombehandlung geprüft wurde. In einer monoinstitutionellen Studie mit 125 Patientinnen, die weder placebokontrolliert noch verblindet war, fand sich nach einem Follow-up von ≥48 Monaten kein signifikanter Unterschied zum krankheitsfreien bzw. Gesamtüberleben zwischen HRT-Anwenderinnen und Kontrollen, einige Studien beschrieben sogar einen positiven Effekt auf das Gesamtüberleben der Patientinnen [25–31]. Hinsichtlich dieser Thematik ist sicherlich Vorsicht geboten. Ovarialkarzinome sind überwiegend ER positiv. Da es Daten gibt, die eine gewisse Wirk- samkeit von Aromataseinhibitoren beim Ovarialkarzinom zeigen, sollte die Anwendung Östrogenpräparaten durchaus kritisch hinterfragt werden [32] und die Indikationsstellung entsprechend streng sein.
Zervixkarzinom
Als letztes unter den Genitalmalignomen ist das Zervixkarzinom zu betrachten. Die Verwendung kombinierter oraler Kontrazeptiva über fünf oder mehr Jahre ist mit einem erhöhten Risiko für das Zervixkarzinom assoziiert. Nach Beendigung der Einnahme konnte dagegen eine Risikoreduktion beobachtet werden [33, 34]. Reine Gestagenpräparate sind nicht mit einem erhöhten Risiko assoziiert [33, 35]. Dass die Infektion mit humanen Papillomaviren (HPV) der entscheidende Risikofaktor für die Entstehung eines Zervixkarzinoms ist, ist unbestritten. Wie also erklärt sich die Assoziation mit dem Einsatz von Kontrazeptiva? Es gibt Studien, die bei bereits mit HPV infizierten Patientinnen ein erhöhtes Risiko für ein Zervixkarzinom durch orale Kontrazeptiva beschreiben, und zwar abhängig von der Einnahmedauer [36]. Ob dies durch eine Schwächung der lokalen Immunabwehr oder andere Mechanismen zu erklären ist, ist nicht abschliessend geklärt. Die orale Kontrazeption mit Kombinati- onspräparaten scheint somit zwar kein Haupt-, wohl aber ein Kofaktor zu sein, die den Verlauf einer HPV-Infektion allenfalls ungünstig beeinflussen kann. Die Karzinome selbst sind in den meisten Fällen nicht endokrin sensibel. Die Verordnung einer Hormonersatztherapie nach Behandlung eines Zervixkarzinoms scheint nicht mit einem schlechteren Überleben assoziiert zu sein, sie sollte daher gerade bei jungen Patientinnen in Erwägung gezogen werden [37].
Mammakarzinom
Wohl kaum ein Thema ist im letzten Jahrzehnt so intensiv diskutiert worden wie der Einsatz der Hormonersatztherapie und die damit verbundene Erhöhung des Brustkrebs-Risikos.
Nach Veröffentlichung der WHI-Studie (Women’s Health Initiative) im Jahr 2002 und 2004 [38, 39] ging der Einsatz der Hormone zur Behandlung von Wechseljahresbeschwerden von knapp 40 % am Ende der 1990er-Jahre auf etwa 10 % der postmenopausalen Frauen zurück.
Doch wie sieht die Situation aktuell nach kritischer Bewertung der WHI-Studie und verschiedenen Subgruppenanalysen aus? Nach wie vor ist die WHI-Studie die grösste prospektive randomisierte Placebokontrollierte Studie zum Thema HRT. Etwa 16 000 postmenopausale Frauen mit intaktem Uterus erhielten eine kombinierte HRT oder ein Placebo. In einem parallelen zweiten Studienarm erhielten ca. 10 000 postmenopausale hysterektomierte Frauen eine Östrogenmonotherapie oder ein Placebo. Interessanterweise lag das Durchschnittsalter bei Beginn der HRT bei 63 Jahren, womit die Frauen in der WHI-Studie ca. zehn Jahre älter waren als das mittlere Menopausenalter (bei 52 Jahren). Auch hatten die Studienteilnehmerinnen zum Teil beträchtliche Co-Morbiditäten. Dies muss bei der Interpretation der Studiendaten beachtet werden. In einem Artikel im New England Journal of Medicine aus dem Jahr 2016 haben zwei der Autoren der WHI-Studie Fehler bei der Interpretation der Studiendaten eingeräumt. Der Nutzen einer HRT bei menopausalen Patientinnen überwiegt aus Sicht der Autoren (und auch verschiedener Fachgesellschaften) die Risiken, wenn diese früh begonnen wird [40].
Das Mammakarzinomrisiko ist in der WHI-Studie für die Östrogenmonotherapie reduziert gewesen – bei den 50- bis 59-Jährigen sogar signifikant – wohingegen im Kombinationsarm (erst) nach fünfjähriger Therapie das Brustkrebsrisiko signifikant erhöht war. Sicher muss man vorsichtig sein bei Bewertung der Risikoreduktion von Brustkrebs durch eine reine Östrogengabe. Möglicherweise zeigt sich dieser günstige Effekt vor allem bei adipösen Frauen, indem via Überwindung einer Insulinresistenz durch die Östrogengabe auch das Mammakarzinomrisiko gesenkt wird.
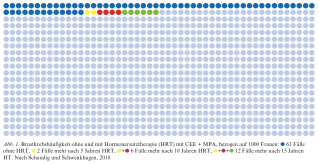
Für die Kombinationstherapie ist in der WHI-Studie eine Risikoerhöhung für das Mammakarzinom gezeigt worden. Die absolute Zunahme sah folgendermassen aus: nach fünf Jahren zwei zusätzliche Brustkrebsfälle pro 1000 Frauen, nach zehn Jahren sechs zusätzliche Brustkrebsfälle und nach 15 Jahren 12 zusätzliche Brustkrebsfälle pro 1000 Frauen. Für die Gestagene Norethisteronacetat und MPA ist bei mehr als fünfjähriger Anwendung in Kombination mit einem Östrogen also ein erhöhtes Mammakarzinomrisiko nachgewiesen. Ob es günstigere Gestagene als Kombinationspartner gibt, kann aufgrund der mangelnden Datenlage nicht schlüssig gesagt werden.
Sicherlich sollten Frauen mit HRT vor Therapiebeginn, aber auch unter der laufenden Therapie, regelmässige klinische Kontrollen inklusive Vorsorgemammographien empfohlen werden.
Nun noch eine kurze Zusammenfassung der Situation bei Frauen mit klimakterischen Beschwerden und Status nach Mammakarzinom. Hier ist die Hormonersatztherapie klar kontraindiziert. Die HABITS-Studie aus Schweden hat in einem prospektiv-randomisierten Setting gezeigt, dass in der HRT-Gruppe signifikant mehr Rezidive und Zweitkarzinome auftraten (RR 3.5; 95 % KI: 1.5–8.1) [41]. Auch für Tibolon liegt eine internationale, multizentrische, randomisierte, placebo-kontrollierte Studie vor (Liberate), die ebenfalls signifikant mehr Rezidive/Metastasen in der Tibolongruppe aufwies (RR 1.40; 95 % KI: 1.14–1.70 für Rezidiv, RR 1.38; 95 % KI: 1.09–1.74 für Metastasen) [42]. Damit stellen alternative Behandlungsoptionen die einzig vertretbare Option zur Linderung systemischer klimakterischer Beschwerden dar.
Nach wie vor gibt es wenig valide Informationen, ob die heute gängigen hormonellen Kontrazeptiva das Brustkrebsrisiko erhöhen. Grössere Studien, die allerdings sämtlich retrospektiven Charakter hatten, zeigten kein oder nur ein sehr gering erhöhtes Risiko, an einem Mammakarzinom zu erkranken [43]. Eine 2012 veröffentlichte Studie des Centers for Disease Control and Prevention zeigte bei einer Analyse von knapp 10 000 Patientinnen keine signifikante Erhöhung des Brustkrebsrisikos [44].
Die grösste Risikoerhöhung wurde in einer dänischen prospektiven Kohortenstudie beschrieben, hier betrug das relative Risiko 20 %, was einer zusätzlichen Mammakarzinomdiagnose auf 7690 Anwenderinnen pro Jahr entspricht [45]. Interessanterweise fand sich die Risikoerhöhung nicht nur bei verschiedenen oralen Estrogen-Gestagen-Präparaten (RR lag zwischen 1.0 und 1.6), sondern auch bei der Verwendung des gestagen-abgebenden Intrauterinpessars (RR 1.21; 95 % KI, 1.11–1.33). Diese Studie hat erstmals auch die neueren Kontrazeptiva inklusive Hormonspirale untersucht und gezeigt, dass auch mit den niedrigen Hormonkonzentrationen dieser Substanzen das Brustkrebsrisiko erhöht werden kann. In absoluten Zahlen gesehen scheint dieses Risiko klein, jedoch sollten Frauen bei der Abwägung für oder gegen eine hormonelle Verhütungsmethode über das eventuell bestehende Risiko informiert werden.
Zusammenfassend haben wir aktuell eine breite Datenbasis, auf deren Grundlage wir unsere Patientinnen beraten können. Gerade hinsichtlich einer Hormoner satztherapie wird diese Beratung auf die individuellen Bedürfnisse und vorbestehende Risiken eingehen müssen. Aktuell nimmt die Lebenserwartung in unserem Land weiter zu. Gleichzeitig steigen verständlicherweise die Ansprüche an die Lebensqualität im Alter, ein möglichst langer Erhalt von Jugendlichkeit wird von vielen als erstrebenswertes Ziel angesehen. Die Hormonersatztherapie wird daher vermutlich weiterhin und allenfalls verstärkt nachgefragt werden. Eine qualifizierte Beratung ist für die Versorgung und Betreuung unserer Patientinnen von entscheidender Bedeutung.